深圳欣博盛生物科技有限公司品牌商
16 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0
- 0
- 2
- 2
全部产品
- 查看全部分类
- 欣博盛ELISA 试剂盒
- Vectorlabs
- GeneTex
- Peprotech
- Invivogen
- BioXcell
- FuGENE
- Prozyme
- Cayman
- Mirusbio
- ENZO(Alexis, Biomol, Assaydesign&stressgen)
- AbD Serotec
- Surmodics
- Millipore
- Metasystems
- Mabtech
- Proimmune
- Adipogen
- Bioporto
- Southern Biotech (SBA)
- Everest Biotech
- Chondrex
- IQ Products
- Atlas
- Detroit R&D
- StressMarq
- Cell Biolabs
- StrigoLab
- Synaptic Systems
- BioInnovatise
- Cosmo Bio
- Abwiz Bio
- Gerbu
- 蛋白
- 试剂类
- 抗体
- 分子化合物
- Cargille
- Antagen
- Nanoprobes
- Funakoshi
- Demeditec
- Enzo
- Fitzgerald
- Biovendor
- ICL
- Matreya
- PhaRNA
- Funakoshi
- Promise Advanced Proteomics
- Bioassay works
- NSJ Bio
- Aldevron
- CalBioreagents
- 3Helix
- 自产试剂盒
- TriLink
- Virostat
- Agilent
- Epicypher
- Jackson ImmunoResearch
推荐产品
公司新闻/正文
InvivoGen 解码 STING
805 人阅读发布时间:2019-04-04 11:35
STING(干扰素基因刺激物)是天然免疫学研究和免疫治疗领域的新贵,它可被小核酸,包括 cyclic dinucleotide(CDNs)所激活,从而诱导 I 型干扰素和其它炎症因子的产生。STING 的配体包括微生物在感染过程中释放的 CDNs,和 cGAS 应答胞浆 DNA 过程中产生的内源性 CDN 2'3'-cGAMP。关于 STING 的功能、STING 与其它核酸感知物及配体间的相互作用、STING 在感染性疾病,癌症,自身免疫病及疫苗佐剂中的作用等,虽然文献报道与日俱增,却仍有很多研究需要深入探讨。InvivoGen 公司提供全世界最全的 STING 产品,协助您研究 STING 应答机制以及 STING 相关疾病的治疗。
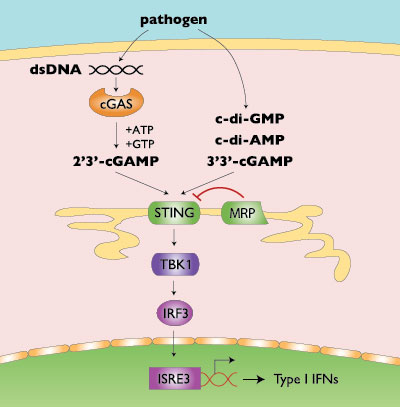
STING- STING(Stimulator of interferon genes,干扰素基因刺激物,又名 TMEM173、ERIS、MITA、MPYS、NET23),是一个内质网接头和感知蛋白,它在天然免疫反应中发挥重要作用,特别是在维持机体动态平衡、抵御外来感染以及预防肿瘤和自身免疫病方面。STING 活化之后,通过 TBK1(TANK 结合激酶 1)/ IRF3(干扰素调节因子 3)1 信号通路来诱导 I 型干扰素(如 IFN-β)的表达,还可通过 NF-kB 信号通路来调控炎症因子(如 TNF-α和 IL-6)的表达 1, 2。这些细胞因子可高效调控一系列下游分子事件,包括多种免疫细胞、其它细胞因子和趋化因子。
STING 和 Cyclic dinucleotide – STING 可被小核酸,即 cyclic dinucleotide(CDNs)活化,这些 CDNs 包括 c-di-GMP3、c-di-AMP4 和 cGAMP5, 6。值得一提的是,在 STING 被发现之前,其中一些 CDNs 已被证明是微生物中的重要第二信使分子。十年前,c-di-GMP 已被发现可在哺乳动物细胞(真核细胞)中引起强烈的免疫反应;直到最近,它和其它 CDNs 才被发现是 STING 的激动剂。外来微生物感染过程中,宿主细胞表达的 STING 可被侵袭微生物释放的 CDNs 激活。
Cytosolic DNA,cGAS 和 STING – 最近天然免疫学研究领域的一个重大突破是多细胞生物体 cGAMP 和胞浆 DNA 感受因子,以及 cGAS(环-GMP-AMP 合成酶)被几个实验室同时发现 5, 7。监测到病毒、细菌或细胞浆中的内源 DNA 后,cGAS 诱导产生 cGAMP,cGAMP 与 STING 结合后诱导 I 型干扰素的产生。
Microbial vs. metazoan CDNs(微生物和多细胞生物的 CDNs)– 非常有趣的是,后来人们才发现多细胞生物体也可以合成内源的 CDNs 来激活 STING。对于微生物的 CDNs,两个核苷酸之间是通过经典的磷酸二酯键 [G(3',5')pA(3',5')p] 相连接的;与此不同的是,多细胞生物体的 CDNs,两个核苷酸之间通过非经典的磷酸二酯键 a[G(2',5')pA(3',5')] 相连接6, 8。因而产生了细菌 CDN 的 3',3'-cGAMP 和哺乳动物 cGAS-cGAMP 的 2',3'-cGAMP 两种不同命名方式。有意思的是,细菌 3',3'-cGAMP 和多细胞生物 2',3'-cGAMP 结合在 STING 的同一活性部位上9。
CDNs 的体内稳定性 – CDNs 在体内可被多种核酸酶和磷酸二酯酶降解,其中一些具有高度特异性。特别是,ENPPI 酶可降解 2',3'-cGAMP 却不能降解它的合成类似物二聚寡核苷酸类似物或经典的 3',3'-cGAMP25。其中一些酶对于微生物感染过程至关重要,例如,结核分枝杆菌(Mycobacterium tuberculosis)能够成功感染宿主的重要原因之一就是致病菌能够利用它的磷酸二酯酶降解自己的 c-di-AMP,从而阻止其对宿主 STING 通路的激活26。因此,利用 STING 作为药物靶点的策略之一就是设计人工合成不能被酶解的 CDNs。
STING 和其它核酸感受器 – 越来越多的证据表明 cGAS 是最为关键的细胞浆 DNA 感受器,可以引起 STING 的活化。STING 上游的一些其它感受分子可能与其有相互作用,包括 IF11610、DDX4111、MRE1112 和 IFIX13(如图所示)。除了可对胞内 DNA 产生反应外,STING 还可参与 RIG-1 识别病毒 RNA 后激活的信号通路,这些病毒包括日本脑炎病毒、新城疫病毒和水疱性口炎病毒14。STING、cGAS 和其它 DNA 感受分子间的相互作用需要进一步阐明。

STING 和人类健康 – 作为细胞因子信号通路的调节者,STING 与多种疾病的病理及临床表症密切相关,包括前面提及的感染性疾病、癌症和自身免疫病。 一般情况下,STING 的正常活性维持免疫系统的正常功能,STING 活性缺失导致免疫缺陷,STING 过度活化导致免疫过激。值得一提的是,cGAS/STING 信号通路的正常活化可引发机体对肿瘤细胞的免疫应答15, 16,进而增强肿瘤放射疗法的疗效:cGAS 可感知被杀死的肿瘤细胞释放的 DNA,来活化 STING 来诱导树突状细胞产生 I 型干扰素,进而激活潜在的抗肿瘤免疫反应17。STING 活性的缺失可引发肿瘤或一些特定的病毒感染18, 19。例如,登革病毒的蛋白酶 NS2B3 可通过降解 STING 来阻碍 IFN-α/β的产生20。因此,可激活 STING 的 CDNs 被广泛用作疫苗佐剂或免疫激活剂21, 22。反之,过度的 STING 活性被认为与多种自身免疫病有关,包括狼疮23 和 SAVI(STING-Associated Vasculopathy with Onset in Infancy)24。综上,STING 激动剂可通过激活 STING 从而达到疾病治疗的效果,而 STING 抑制剂亦可以调节 STING 而控制持续活化的细胞因子来降低危害。
STING 的基因多样性 – 人源 STING 由 Tmem173 基因所编码,在人群中具有多个剪接体,最为常见的是 R232 剪接体,被作为野生型。最新研究表明,STING 剪接体间的微小区别可导致重大的功能差异。例如,R232Q 突变体感知微生物 CDNs 的能力相对于野生型显著降低;另一个突变体,V155M,是一个功能增强型突变,能够组成性激活 STING,上调 I 型干扰素的表达,从而导致自身炎症性疾病23, 24。深入了解 STING 剪接体的临床意义将有助于以 STING 为基础的诊断治疗手段的开发。
InvivoGen 和 STING – InvivoGen 公司提供最全面的 STING 相关产品,并不断更新产品目录,帮助您进行 STING 领域的体内和体外研究,其中包括 STING 激动剂、各种 STING 剪接体质粒、STING 报告细胞系(包括 STING 敲除细胞系)、Ⅰ型干扰素的 ELISA 试剂盒和 CDN 磷酸二酯酶(ENPPI)质粒。我们紧随科研新发现的脚步,不断更新 STING 配体,包括天然 CDNs 和类似合成物等。我们还提供癌症治疗剂 DMXAA,STING 的鼠源特异性激动剂。另外,我们研发了一系列 STING-IFN 信号通路中多种重要分子的基因敲除 THP-1,RAW 细胞系、及以这些基因为靶点的 siRNA。这些基因包括 TBK1 和 IRF3,以及最近被证明与 cGAS/STING 有相互作用的蛋白,例如 AIM2,IFI16,cGAS,DDX41,TREX1 和 RIG-I。
STING 报告细胞系
STING 激活后通过 IRFs(干扰素调节因子)来诱导 ISG(干扰素激活基因)的表达。为了方便您分析研究 STING 的配体,InvivoGen 开发了 STING 被敲除(knockout)的稳定的报告细胞系。这些细胞系采用 IRF 诱导的分泌型的报告蛋白,SEAP(分泌型碱性磷酸酶)或 Lucia 荧光素酶作为监测指标。
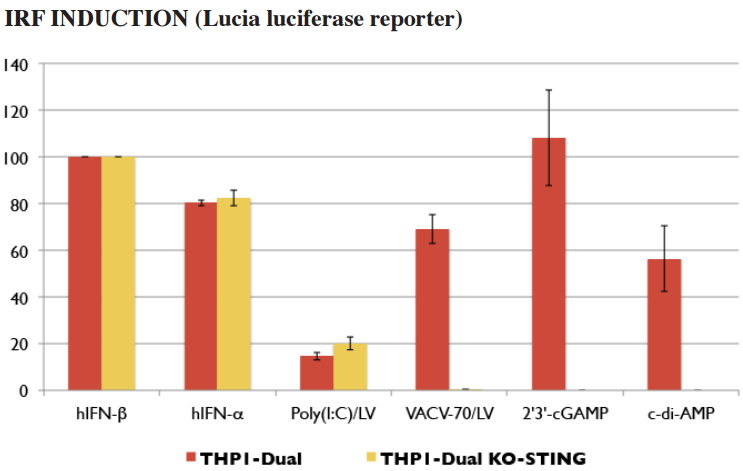
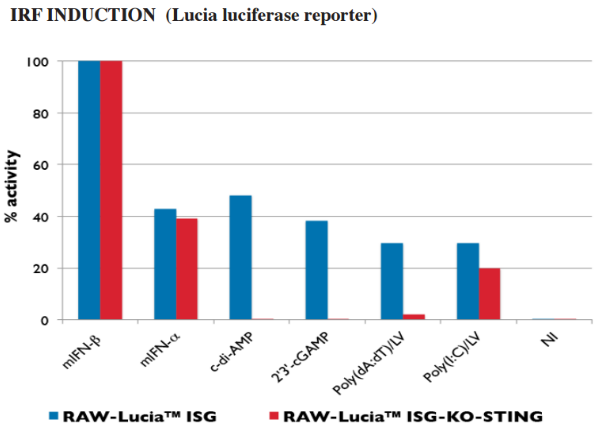
Ⅰ型干扰素 ELISA 检测试剂盒 – LumiKine™
LumiKine™ 是 InvivoGen 公司提供的新一代免疫试剂盒,可快速、灵敏、特异性检测细胞因子,特别是Ⅰ型干扰素的水平。通过采用光敏快速的 Lucia 荧光素酶(QUANTI-Luc™)生物发光监测系统替代了传统 ELISA 的以吸光度为基础的酶联免疫法,亦可通过 streptavidin 结合剂,用普通的酶标仪进行检测。
参考文献:
1. Ishikawa H. & Barber GN., 2008. STING is an endoplasmic reticulum adaptor that facilitates innate immune signalling. Nature. 455(7213):674-8.
2. Abe T. &Barber GN., 2014. Cytosolic-DNA-mediated, STING-dependent proinflammatory gene induction necessitates canonical NF-κB activation through TBK1. J Virol. 88(10):5328-41.
3. Burdette DL. et al., 2011. STING is a direct innate immune sensor of cyclic di-GMP. Nature. 478(7370):515-8. 4. Barker JR. et al., 2013. STING-dependent recognition of cyclic di-AMP mediates type I interferon responses during Chlamydia trachomatis infection. MBio. 4(3):e00018-13.
5. Wu J. et al., 2013. Cyclic GMP-AMP is an endogenous second messenger in innate immune signaling by cytosolic DNA. Science. 339(6121):826-30.
6. Ablasser A. et al., 2013. cGAS produces a 2'-5'-linked cyclic dinucleotide second messenger that activates STING. Nature. 498(7454):380-4.
7. Sun L. et al., 2013. Cyclic GMP-AMP synthase is a cytosolic DNA sensor that activates the type I interferon pathway.Science. 339(6121):786-91.
8. Zhang X. et al., 2013. Cyclic GMP-AMP containing mixed phosphodiester linkages is an endogenous high-affinity ligand for STING. Mol Cell. 51(2):226-35.
9. Gao P. et al., 2013. Structure-function analysis of STING activation by c[G(2',5')pA(3',5')p] and targeting by antiviral DMXAA. Cell. 154(4):748-62.
10. Unterholzner L. et al., 2010. IFI16 is an innate immune sensor for intracellular DNA. Nat Immunol. 11(11):997-1004.
11. Zhang Z., et al., 2011. The helicase DDX41 senses intracellular DNA mediated by the adaptor STING in dendritic cells. Nature Immunology.12: 959–965.
12. Kondo T. et al., 2013. DNA damage sensor MRE11 recognizes cytosolic double-stranded DNA and induces type I interferon by regulating STING trafficking. Proc Natl Acad Sci U S A. 110(8):2969-74.
13. Diner BA. et al., 2015. The functional interactome of PYHIN immune regulators reveals IFIX is a sensor of viral DNA. Mol Syst Biol. 11(2):787.
14. Ran Y. et al., 2014. MITA/STING: a central and multifaceted mediator in innate immune response. Cytokine Growth Factor Rev. 25(6):631-9.
15. Woo SR. et al., 2014. STING-dependent cytosolic DNA sensing mediates innate immune recognition of immunogenic tumors. Immunity. 41(5):830-42.
16. Klarquist J. et al., 2014. STING mediated DNA sensing promotes antitumor and autoimmune responses to dying cells. J Immunol. 193(12):6124-34.
17. Deng L. et al., 2014. STING-Dependent Cytosolic DNA Sensing Promotes Radiation-Induced Type I Interferon-Dependent Antitumor Immunity in Immunogenic Tumors. Immunity. 41(5):843-52.
18. Zhu Q. et al., 2014. Cutting edge: STING mediates protection against colorectal tumorigenesis by governing the magnitude of intestinal inflammation. J Immunol. 193(10):4779-82.
19. Ahn J. et al., 2015. Diverse roles of STING-dependent signaling on the development of cancer. Oncogene. [Ahead of print].
20. Aguirre S. et al., 2012. DENV inhibits type I IFN production in infected cells by cleaving human STING. PLoS Pathog. 8(10):e1002934.
21. Dubensky TW Jr. et al., 2013. Rationale, progress and development of vaccines utilizing STING-activating cyclic dinucleotide adjuvants. Ther Adv Vaccines. 1(4):131-43.
22. Chandra D. et al., 2014. STING ligand c-di-GMP improves cancer vaccination against metastatic breast cancer. Cancer Immunol Res. 2(9):901-10.
23. Jeremiah N. et al., 2014. Inherited STING-activating mutation underlies a familial inflammatory syndrome with lupus-like manifestations. J Clin Invest. 124(12):5516-20.
24. Liu Y. et al., 2014. Activated STING in a vascular and pulmonary syndrome. N Engl J Med. 371(6):507-18.
25. Li L. et al., 2014. Hydrolysis of 2'3'-cGAMP by ENPP1 and design of nonhydrolyzable analogs. Nat Chem Biol. 10(12):1043-8.
26. Yang J. et al., 2014. Deletion of the cyclic di-AMP phosphodiesterase gene (cnpB) in Mycobacterium tuberculosis leads to reduced virulence in a mouse model of infection. Mol Microbiol. 93(1):65-79.






